 أم زينبالمديرة العامة
أم زينبالمديرة العامة
 عدد المساهمات : 15740
عدد المساهمات : 15740
نقاط : 135570
تاريخ التسجيل : 08/01/2011
 مراجعة نهائية كيمياء الجزء الأول ثانوية عامة
مراجعة نهائية كيمياء الجزء الأول ثانوية عامة
الأربعاء 29 أبريل 2015, 19:50
مراجعة نهائية كيمياء الجزء الأول ثانوية عامة
مراجعة نهائية كيمياء الجزء الأول ثانوية عامة
لتحميل الدرس بصيغة PDF اضغط هنا..
- يشغل 22.4 لتراً فى stp د- جميع ما سبق .





علماً بأن جهد أكسدة النحاس = -34, فولت.
يتأثر معدل التفاعل (سرعته) بعدد من العوامل هى :
1- طبيعة المواد المتفاعلة : نوع الترابط فى المواد المتفاعلة إذا كانت المواد المتفاعلة أيونية يكون التفاعل سريع ولحظى بينما إذا كانت المواد المتفاعلة تساهمية يكون التفاعل بطئ .
2- تركيز المواد المتفاعلة : تلعب درجة تجزئة المادة دوراً مهماً فى زيادة سرعة التفاعل فكلما زادت عدد الجزيئات المتفاعلة كلما زادت فرص التصادم وزادت سرعة التفاعل .
3- درجة حرارة التفاعل : زيادة درجة الحرارة للتفاعل يزيد نسبة الجزيئات المنشطة وبالتالى يزيد معدل التفاعل الكيميائى .
4- زيادة الضغط أو التبريد على تفاعل غازى متزن تجعله ينشط فى الاتجاه الذى يقل فيه الحجم .
مراجعة نهائية كيمياء الجزء الأول ثانوية عامة
لتحميل الدرس بصيغة PDF اضغط هنا..
السؤال الأول :
أولاً : اختر الإجابة الصحيحة لكل عبارة مما يلى :
1- يتفاعل البنزين مع الكلور فى ضوء الشمس المباشر مكوناً ¼¼
أ- سيكلوهكسان . ب- هكسان عادى . ج- جامكسان . د- كلورو بنزين .2- القانون الذى يدرس العلاقة بين سرعة التفاعل الكيميائى وتركيز المتفاعلات اكتشفه العالم ¼¼
أ- لوشاتيليه . ب- أفوجادرو . -G جاى لوساك . د- جولدبرج وفاج .3- كمية الكهرباء اللازمة لترسيب ذرة جرامية من الألمونيوم فى التفاعل . Al+3 + 3e- ® Al يساوى ¼
أ- 0.5 فاراداى ب- فاراداى . ج- فاراداى . د- 0.3 فاراداى .4- غاز الأكسجين ¼¼
أ- 32 جرام . ب- 6.02 × 2310 جزئ -G 2 (6.02 × 2310 ) ذرة- يشغل 22.4 لتراً فى stp د- جميع ما سبق .
5- الرقم الهيدروجينى لخمض الهيدروكلوريك 001, مول / لتر يساوى ¼¼
أ- 3 ب- 1 -G ( -3) – 11ثانياً : أ- قارن بين كل مما يأتى :
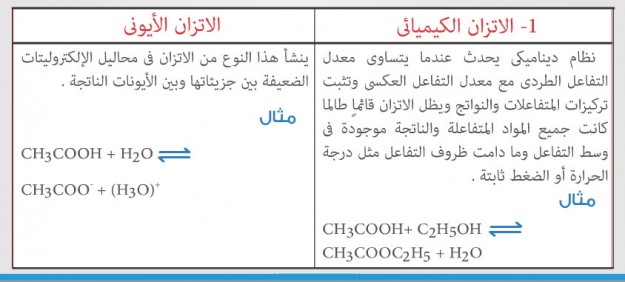
1- الاتزان الكيميائى والاتزان الأيونى . 2- بلمرة بالإضافة وبلمرة بالتكاثف .
3- قانون أفوجادرو وقانون جاى لوساك . 4- الخلية الجافة وخلية الزئبق .




ب- اكتب أسماء المركبات الآتية حسب نظام الأيوباك .


ثالثاً : أ- اكتب الرمز الاصطلاحى ، العامل المؤكسد ، العامل المختزل ، احسب القوة الدفعة الكهربية
فى الخلية الجلفانية الآتية : H20 + Cu+2 ® 2H+ + Cu0علماً بأن جهد أكسدة النحاس = -34, فولت.
ب- اشرح باختصار ما يلى : معدل التفاعل الكيميائى والعوامل التى تؤثر عليه .
ب- معدل التفاعل الكيميائى : هو مقدار التغير فى تركيز المواد المتفاعلة فى وحدة الزمنيتأثر معدل التفاعل (سرعته) بعدد من العوامل هى :
1- طبيعة المواد المتفاعلة : نوع الترابط فى المواد المتفاعلة إذا كانت المواد المتفاعلة أيونية يكون التفاعل سريع ولحظى بينما إذا كانت المواد المتفاعلة تساهمية يكون التفاعل بطئ .
2- تركيز المواد المتفاعلة : تلعب درجة تجزئة المادة دوراً مهماً فى زيادة سرعة التفاعل فكلما زادت عدد الجزيئات المتفاعلة كلما زادت فرص التصادم وزادت سرعة التفاعل .
3- درجة حرارة التفاعل : زيادة درجة الحرارة للتفاعل يزيد نسبة الجزيئات المنشطة وبالتالى يزيد معدل التفاعل الكيميائى .
4- زيادة الضغط أو التبريد على تفاعل غازى متزن تجعله ينشط فى الاتجاه الذى يقل فيه الحجم .
- مراجعة كيمياء العضوية الجزء الأول ثانوية عامة
- بالفيديو مراجعة نهائية ثانوية عامة مادة اللغة العربية - الاستاذ ناصر شعبان - الجزء الأول
- مراجعة نهائية على الكيمياء الجزء الثالث ثانوية عامة
- بالفيديو مراجعة نهائية ثانوية عامة مادة اللغة العربية - الاستاذ ناصر شعبان - الجزء الثاني
- مراجعة نحو الجزء الأول لغة عربية ثانوية عامة
صلاحيات هذا المنتدى:
لاتستطيع الرد على المواضيع في هذا المنتدى


